Đề thi học kỳ I môn Hóa 10 năm học: 2006 - 2007
Câu 1(0,25đ): Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là:
A. electron và proton .
B. proton và nơtron .
C. electron, proton và nơtron
D. nơtron .
Câu 2(0,25đ): Lớp vỏ nguyên tử được cấu tạo bởi hạt:
A. electron
B. electron và nơtron
C. nơtron
D. proton
Câu 3(0,75đ): Cho các nguyên tử có cấu hình electron như sau:
1s22s22p6 (1); 1s22s22p63s1 (2); 1s22s22p63s23p5 (3); 1s22s22p3 (4) ; 1s22s22p63s23p1 (5).
a) Có mấy nguyên tử là kim loại?
A. 2 ; B. 1 ; C. 3 ; D. 5
b) Có mấy nguyên tử là khí hiếm?
A. 1 ; B. 2 ; C. 5 ; D. 4
c) Có mấy nguyên tử là phi kim?
A. 1 ; B. 2 ; C. 3 ; D. 4
d) Số hiệu nguyên tử của các nguyên tử trên lần lượt là:
A. 10, 11, 17, 7, 13.
B. 10, 15, 17, 7, 13.
C. 10, 11, 16, 7, 13.
D. 10, 10,17, 7, 13.
e) Điện tích hạt nhân của các nguyên tử trên lần lượt là:
A. 10+, 11+, 17+, 7+, 13+.
B. 10-, 11+, 17+, 7+, 13+.
C. 10-, 11-, 17-, 7-, 13-.
D. 10+, 10+, 17+, 7+, 13+.
f) Số lớp electron của các nguyên tử trên lần lượt là:
A. 2, 3, 3, 2, 3
B. 3, 3, 3, 2, 3
C. 2, 2, 3, 2, 3
D. 2, 3, 2, 2, 3
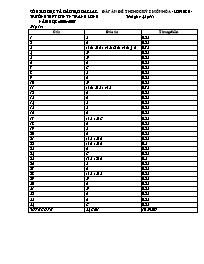
SỞ GIÁO DỤC VÀ ĐÀO TẠO DAKLAK ĐÁP ÁN ĐỀ THI HỌC KỲ I MÔN HÓA - LỚP10CB- TRƯỜNG THPT DTNT N’TRANG LƠNG Thời gian 45 phút NĂM HỌC: 2006-2007 Đáp án: Câu Đáp án Thang điểm 1 B 0,25 2 A 0,25 3 a) A; b) A ; c) B; d) A; e) A; f) A 0,75 4 D 0,25 5 D 0,25 6 A 0,25 7 C 0,25 8 B 0,25 9 A 0,25 10 D 0,25 11 a) A; b) B ; c) B 0,75 12 A 0,25 13 A 0,25 14 B 0,25 15 B 0,25 16 A 0,25 17 a) B ; b) C 0,25 18 A 0,25 19 B 0,25 20 A 0,25 21 a) B ; b) A 0,25 22 a) A ; b) A 0,5 23 A 0,25 24 C 0,25 25 1) B ; 2) A 0,5 26 B 0,25 27 A 0,25 28 a) B ; b) B 0,25 29 D 0,25 30 A 0,25 31 D 0,25 32 A 0,25 33 A 0,25 34 C 0,25 TỔNG CỘNG 34 CÂU 10 ĐIỂM SỞ GIÁO DỤC VÀ ĐÀO TẠO DAKLAK ĐỀ THI HỌC KỲ I MÔN HÓA 10 CB TRƯỜNG THPT DTNT N’TRANG LƠNG Thời gian 45 phút NĂM HỌC: 2006-2007 Trắc nghiệm : 10Đ -Hãy chọn một phương án trả lời đúng nhất: Câu 1(0,25đ): Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là: electron và proton . proton và nơtron . electron, proton và nơtron nơtron . Câu 2(0,25đ): Lớp vỏ nguyên tử được cấu tạo bởi hạt: electron electron và nơtron nơtron proton Câu 3(0,75đ): Cho các nguyên tử có cấu hình electron như sau: 1s22s22p6 (1); 1s22s22p63s1 (2); 1s22s22p63s23p5 (3); 1s22s22p3 (4) ; 1s22s22p63s23p1 (5). a) Có mấy nguyên tử là kim loại? A. 2 ; B. 1 ; C. 3 ; D. 5 b) Có mấy nguyên tử là khí hiếm? A. 1 ; B. 2 ; C. 5 ; D. 4 c) Có mấy nguyên tử là phi kim? A. 1 ; B. 2 ; C. 3 ; D. 4 d) Số hiệu nguyên tử của các nguyên tử trên lần lượt là: 10, 11, 17, 7, 13. 10, 15, 17, 7, 13. 10, 11, 16, 7, 13. 10, 10,17, 7, 13. e) Điện tích hạt nhân của các nguyên tử trên lần lượt là: 10+, 11+, 17+, 7+, 13+. 10-, 11+, 17+, 7+, 13+. 10-, 11-, 17-, 7-, 13-. 10+, 10+, 17+, 7+, 13+. f) Số lớp electron của các nguyên tử trên lần lượt là: 2, 3, 3, 2, 3 3, 3, 3, 2, 3 2, 2, 3, 2, 3 2, 3, 2, 2, 3 Câu 4(0,25đ): Sự khác nhau giữa và là: A. Một electron ; B. Một proton ; C. Một electron và một proton ; D. Một nơtron Câu 5(0,25đ): Một nguyên tử X tổng số hạt là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. Số khối của X là: A. 24 ; B. 25 ; C. 26 ; D. 27 Câu 6(0,25đ): Trong tự nhiên, đồng có 2 đồng vị và . Khối lượng nguyên tử trung bình của đồng là 63,54. Thành phần % các đồng vị và lần lượt là: A. 27% và 73% ; B. 26% và 74% ; C. 73% và 27%; D. 29% và 71%. Câu 7(0,25đ): Số electron tối đa ở mỗi lớp electron được tính theo công thức: A. 2n ; B. n2 ; C. 2n2 ; D. 2n (n4) Câu 8(0,25đ): Nguyên tử có cấu hình electron là: 1s22s22p63s23p63d94s1 1s22s22p63s23p63d104s1 1s22s22p63s23p64s23d9 1s22s22p63s23p64s13d10 Câu 9 (0,25đ): : Nguyên tử là phần tử nhỏ nhất của chất: Không mang điện. Mang điện tích dương. Mang điện tích âm. Có thể mang điện hoặc không mang điện. Câu 10 (0,25đ): : Tổng số hạt proton, nơtron, electron trong nguyên tử của một nguyên tố là 13, số khối của nguyên tử đó là: A. 6 ; B. 8 ; C. 11 ; D. 9 Câu 11 (0,75đ): Cho các nguyên tố có số hiệu nguyên tử như sau: Z=17 , Z=13, Z=15, Z=9, Z=11, Z=16 Cl Al P F Na S a.Các dãy sắp xếp theo thứ tự tăng dần của bán kính nguyên tử: A. Cl<S<P<Al<Na B. Al<Na<S<F<Cl C. Na>Al>S>P>Cl D. Na<Al<F<S b. Sắp xếp các nguyên tố theo chiều tính kim loại giảm dần: A. Na>Al>P. B. Na>Al C. Na>Al>S D. Na>Al>Cl c. Sắp xếp các nguyên tố theo chiều tính phi kim giảm dần: A. Cl<S<F<P B. F>Cl>S>P C. F<Cl<P D. F<Cl<S Câu 12 (0,25 đ):Các nguyên tố trong bảng tuần hoàn được sắp xếp theo nguyên tắc: A. Theo chiều tăng dần của điện tích hạt nhân nguyên tử. B. Theo chiều tăng dần của nguyên tử khối trung bình các nguyên tử. C. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một cột. D. Các nguyên tố có số electron hoá trị giống nhau trong nguyên tử được xếp thành một hàng. Câu 13 (0,25 đ): Số thứ tự của ô nguyên tố trong bảng tuần hoàn cho biết: A. Số electron trong lớp vỏ nguyên tử. B. Số nơtron trong hạt nhân nguyên tử của nguyên tố. C. Số khối của nguyên tử nguyên tố. D. Số electron trong một phân lớp của vỏ nguyên tử. Câu 14 (0,25 đ): Chu kì 3 và 4 của bảng tuần hoàn gồm bao nhiêu nguyên tố? A. 8, 16. B. 8, 18. C. 8, 32. D. 2, 8. Câu 15 (0,25) :Cho biết nguyên tố X có số hiệu nguyên tử Z= 15. Cấu hình electron nguyên tử của nguyên tố X là: A. 1s22s22p53s23p3. B. 1s22s22p63s23p3. C. 1s22s22p63s23p4. D. 1s22s22p63s23p5. Câu 16 (0,25đ):Trong bảng tuần hoàn, nguyên tố X có số thứ tự 20, vị trí của nguyên tố X là: A. Chu kì 4, nhóm IIA. B. Chu kì 3, nhóm IIA. C. Chu kì 4, nhóm IIIA. D. Chu kì 5, nhóm VA. Câu 17 (0,25đ): Cho các hợp chất: Na2O (1), CaO (2), Ga2O3 (3), SeO3(4) , Br2O7 (5) a) Hóa trị cao nhất của các nguyên tố trong hợp chất oxit trên lần lượt là: 1, 2, 3, 4, 5; B. 1, 2, 3, 6, 7 ; C. 1, 2, 3, 4, 6 ; D. 1, 2, 3, 5, 6 b) Sự biến đổi tính chất hóa học của các oxit trên lần lượt là: A. Tính axit tăng dần ; B. Tính bazơ giảm dần . C. Tính bazơ giảm dần, tính axit tăng dần ; D. Tính bazơ tăng dần, tính axit giảm dần. Câu 18 ( 0,25 điểm) : Hãy xác định giá trị các chữ cái lần lượt A, B, C, M, N, O, P, I, K trong bảng bằng cách chọn một trong các câu đúng a, b, c, d sau: Số hiệu Ng/tử Số khối Số proton Số nơtron Cấu hình electron Ng/tố s, p, d 8 A B 8 C p 20 40 M N [ Ar] 4s2 O 26 P 26 30 [Ar] 3d64s2 d 29 64 I 35 K d a. 16, 8, 1s22s22p4. 20, 20, s, 56, 29, [Ar] 3d104s1. b. 16, 8, 1s22s22p4, 20, 21, p, 56, 29, [Ar] 3d104s1. c. 16, 8, 1s22s22p4, 20, 20, d, 65, 29, [Ar] 3d104s1. d. 16, 8, 1s22s22p4, 20,20, f, 56, 29, [Ar] 3d104s1. Câu 19 ( 0,25 điểm): Cấu hình electron của ion Fe2+ là: A. 1s22s22p63s23p63d5. B. 1s22s22p63s23p63d6. C. 1s22s22p63s23p63d54s2. D. 1s22s22p63s23p64s23d4. Câu 20 ( 0,25 điểm): Cho hai nguyên tố A, B ở hai ô cách nhau ba ô trong một chu kì của bảng tuần hoàn co ù tổng số proton bằng 26. Số thứ tự của hai nguyên tố lần lượt là: A. 15, 11. B. 14, 12. C. 10, 16. D. 9, 17. Câu 21 ( 0,25 điểm): Từ các nguyên tố N, H, O, Cl, Ca, Mg, S. a. Dãy phân tử nào được hình thành từ liên kết cộng hoá trị không cực? A. NH3, HCl, H2O. B. H2, Cl2, O2, N2. B. CaO, MgCl2, H2S. D. NO, NO2, CaCl2. b. Dãy phân tử nào được hình thành từ liên kết ion? A. CaO, MgO, CaCl2, Mg(OH)2. B. NH3, MgCl2, N2O5. C. H2, SO2, N2O, HCl. D. H2S, CaCl2, CaO. Câu 22 ( 0,5 điểm): Hãy cho biết quá trình nào sau đây là quá trình oxi hoá? Là quá trình khử? 1. Na Ị Na2O. 2. Cu(NO3)2 Ị NO2. 3. FeCl2 Ị FeCl3. 4. KClO3 Ị KCl. 5. H2SO4 Ị SO2 6. KMnO4 Ị MnO2 . 7. K2S Ị S. a. Các quá trình oxi hoá: A. 1, 3, 7. B. 1,2, 7. C. 1, 2, 6. D. 1, 3, 6. b. Các quá trình khử: A. 2, 4, 5, 6. B. 2, 3, 5, 7. C. 2, 4, 5, 7. D. 2, 3, 5, 1. Câu 23 ( 0,25 điểm): Phản ứng hoá học nào sau đây là phản ứng oxi hoá- khử? A. 2Fe + 3Cl2 Ị 2FeCl3. B. H2O + SO2 Ị H2SO3. C. Fe(OH)3 Ị Fe2O3 + H2O. D. Ba(OH)2 + H2SO4 Ị BaSO4 + H2O. Câu 24( 0,25 điểm): Số mol electron cần có để khử 1,5 mol Fe3+ thành Fe là: A. 0,5 mol electron. B. 1,5 mol electron. C. 4,5 mol electron. D. 2,5 mol electron. Câu 25 ( 0,5 điểm): Cho các phản ứng: 1. Cu + HNO3 Ị NO2+ Cu(NO3)2 + H2O 2. Cu(NO3)2 Ị CuO + NO2 + O2 Hệ số của các chất tham gia phản ứng và sản phẩm phản ứng lần lượt là: 1. A. 1, 4, 5, 3, 2. B. 1, 4, 2, 1, 2. C. 1, 3, 2, 5, 2. D. 2, 1, 3, 2, 4. 2. A. 2, 2, 4, 1. B. 2, 2, 1, 1. C. 2, 3, 4, 1. D. 2, 1, 3, 5. Câu 26 (0,25đ): Cho phản ứng 2Na + Cl2 à 2NaCl Trong phản ứng này, Clo: Bị oxi hóa. Bị khử. Vừa bị oxi hóa, vừa bị khử. Không bị oxi hóa, không bị khử. Câu 27 (0,25 đ): Trong các tinh thể sau đây: iot (1), băng phiến (2), kim cương (3), nước đá (4), silic (5) tinh thể nguyên tử là: A, (3), (5) B. (1), (2), (3) C. (2), (3), (4) D. (1), (2), (5) Câu 28 (0,25 đ): Hai nguyên tố X, Y thuộc 2 phân nhóm chính liên tiếp trong bảng tuần hoàn, Y thuộc nhóm 5, ở trạng thái đơn chất X và Y không phản ứng với nhau. Tổng số proton trong hạt nhân X và Y bằng 23. a) X và Y là: N, P S, N S, P S, F b) Cấu hình electron của X và Y là: A. 1s22s22p63s23p4 ; 1s22s22p63s23p3 B. 1s22s22p63s23p4 ; 1s22s22p3 C. 1s22s22p63s23p3 ; 1s22s22p3 D. 1s22s22p63s23p3 ; 1s22s22p4 Câu 29 (0,25 đ): R tạo được oxi cao nhất là RO3. Trong hợp chất với hiđro, R chiếm 94,12% khối lượng. Xác định nguyên tố R, hidroxit cao nhất của R có tính axit hay bazơ? A. R là Photpho, hidroxit cao nhất của R có tính axit. B. R là Mg, hidroxit cao nhất của R có tính bazơ. C. R là Natri, hidroxit cao nhất của R có tính bazơ. D. R là Lưu huỳnh, hidroxit cao nhất của R có tính axit. Câu 30 (0,25 đ): Thả một viên kẽm nhỏ vào dung dịch HCl . Có hiện tượng gì xảy ra ? cho biết vai trò của kẽm và axit clohiđric ( HCl)? Có bọt khí thoát ra. Kẽm là chất bị oxi hóa, axit clohiđric(HCl) chất oxi hóa. Không có hiện tượng gì xảy ra. Kẽm là chất khử, axit clohiđric(HCl) chất oxi hóa. Có bọt khí thoát ra. Kẽm là chất khử, axit clohiđric(HCl) chất bị oxi hóa. Có bọt khí thoát ra. Kẽm là chất khử, axit clohiđric(HCl) chất bị oxi hóa. Câu 31 (0,25 đ): Nguyên tố hóa học là những nguyên tử có cùng: Số khối. Số nơtron. Số electron. Số proton Câu 32 (0,25 đ): Trong một chu kỳ của bảng tuần hoàn từ trái sang phải theo chiều tăng của điện tích hạt nhân thì số electron hóa trị: A.Tăng dần. B.Giảm dần. Tăng. Giảm. Câu 33 (0,25 đ): Cho các ion sau: (1) F-, (2) Na+, (3) Fe2+, (4) Mg2+, (5) SO42- Số electron trong các ion trên lần lượt là: A. 10, 10, 24, 10, 50. B. 10, 11, 25, 10, 51. C. 10, 10, 24, 11, 52. C. 10, 11, 23, 10, 50. Câu 34( 0,25 điểm): Trong các phản ứng dưới đây, phản ứng nào không phải là phản ứng oxi hoá- khử? 1. Zn + 2HCl Ị ZnCl2 + H2. 2. 2FeCl3 + Cu Ị 2FeCl2 + CuCl2. 3. FeS +2 HCl Ị FeCl2 + H2S 4. 2Al(OH)3 Ị Al2O3 + 3H2O. 5. 2Cu(NO3)2 Ị 2CuO + 2NO2 + O2 6. Na2CO3 +2 HCl Ị2NaCl + CO2 + H2O. A. 1, 3, 4, 6. B. 1, 5, 2, 4. C. 3, 4, 6. D. 5, 2, 6.
Tài liệu đính kèm:
 0607_Hoa10ch_hk1_TNTL.doc
0607_Hoa10ch_hk1_TNTL.doc





