Đề cương chi tiết ôn thi tốt nghiệp Hóa học 12 theo chương
Chủ đề 1. Este
1. Khái niệm về este và một số dẫn xuất của axit cacboxylic (đặc điểm cấu tạo phân tử, gọi tên (gốc chức).
2. Phương pháp điều chế este của ancol, của phenol.
3. Tính chất hoá học của este:
+ Phản ứng ở nhóm chức: Thuỷ phân (xúc tác axit), phản ứng với dung dịch kiềm (phản ứng xà phòng hoá), phản ứng khử.
+ Phản ứng ở gốc hiđrocacbon : thế, cộng, trùng hợp
Bạn đang xem 20 trang mẫu của tài liệu "Đề cương chi tiết ôn thi tốt nghiệp Hóa học 12 theo chương", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
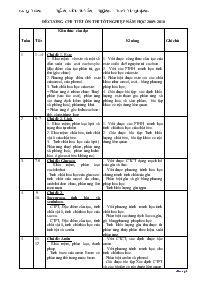
ĐỀ CƯƠNG CHI TIẾT ÔN THI TỐT NGHIỆP NĂM HỌC 2009- 2010 Tuần Tiết Kiến thức cần đạt Kĩ năng Ghi chú 1 1→4 Chủ đề 1. Este 1. Khái niệm về este và một số dẫn xuất của axit cacboxylic (đặc điểm cấu tạo phân tử, gọi tên (gốc chức). 2. Phương pháp điều chế este của ancol, của phenol. 3. Tính chất hoá học của este: + Phản ứng ở nhóm chức: Thuỷ phân (xúc tác axit), phản ứng với dung dịch kiềm (phản ứng xà phòng hoá), phản ứng khử. + Phản ứng ở gốc hiđrocacbon : thế, cộng, trùng hợp 1. Viết được công thức cấu tạo của este có tối đa 5 nguyên tử cacbon . 2. Viết các PTHH minh họa tính chất hoá học của este. 3. Phân biệt được este với các chất khác như ancol, axit... bằng phương pháp hóa học;. 4. Giải được bài tập: xác định khối lượng este tham gia phản ứng xà phòng hoá và sản phẩm, bài tập khác có nội dung liên quan. 2 5- 7 Chủ đề 2. Lipit 1. Khái niệm, phân loại lipit và trạng thái tự nhiên. 2. Khái niệm chất béo, tính chất vật lí của chất béo. 3. Tính chất hoá học của lipit ( Phản ứng thuỷ phân , phản ứng xà phòng hoá, phản ứng hiđro hóa ở gốc axit béo không no). 1. Viết được các PTHH minh họa tính chất hoá học của chất béo. 2. Giải được bài tập: Tính khối lượng chất béo, bài tập khác có nội dung liên quan. 3 7-8 Chủ đề: Glucozo - Khái niệm, phân loại cacbihidrat. - Tính chất hóa học của glucozo: tính chất của ancol đa chức, andehit đơn chức, phản ứng lên men rượu. - Viết được CTCT dạng mạch hở của glu và fruc. - Viết được phương trình hóa học chứng minh tính chất của glu. - Phân biệt glu và gli bằng phương pháp hóa học. - Tính khối lượng glu tgpu. 4 9-10 Chủ đề 2. Saccarozo, tinh bột và xenlulozo. - CTPT, Đặc điểm cấu tạo, tính chất vật lí, tính chất hóa học của sacca. - CTPT, Đặc điểm cấu tạo, tính chất vật lí, tính chất hóa học của tinh bột và xenlu. - Viết phương trình minh họa tính chất hóa học. - Phân biệt các dung dịch Sacca, glu, gli bằng phương pháp hóa học. - Tính khối lượng glu thu được từ phản ứng thủy phân theo hiệu suất phản ứng. 4 11- 12 Chủ đề: Amin - Khái niệm, phân loại, danh pháp. - Tính bazo của amin. Brom có phản ứng thế trong nước brom. - Viết CTCT, xác định được bậc amin. - Viết phương trình minh họa cho tính chất hóa hoc. - Phân biệt anilin và phenol. - Giả được bài tập Xác định CTPT và các bài tập có nội dung liên quan. 5 13- 14 Chủ đề: amino axit - Đặc điểm cấu tạo, khái niệm amino axit. - Tính chất hóa học của amin axit: Tính LT, phản ứng este hóa, phản ứng trùng ngưng. - Viết phương trình chứng minh tính LT của amino axit. - Phân biệt amino axit với các chất hữu cơ khác. - Giả được bài tập Xác định CTPT và các bài tập có nội dung liên quan. 6 15 -17 Chủ đề: peptit- protein. Khái niệm, đặc điểm cấu tạo, tính chất hóa học của peptit và protein. - Viết phương trình minh họa cho tính chất. - Phân biệt protein với các chất lỏng khác. 7 18-20 Chủ đề Polime - Khái niệm, đặc điểm cấu tạo, ứng dụng, phương pháp tổng hợp polime. - Khái niệm, thành phần chính, sản xuất và ứng dụng của chất dẻo, vật liệu compozit, tơ, cao su, keo dán tổng hợp. - Từ polime viết được CTCT của polime và ngược lại. - Viết phương trình tổng hợp 1 số polime thông dụng. - Phân biệt pilime thiên nhiên với polime tổng hợp hoặc nhân tạo. 8- 9 21-27 Chủ đề: Đại cương kim loại - Vị trí, cấu hình e lớp ngoài cùng, một số kiểu mạng tinh thể kim loại phổ biến, liên kết kim loại. - Kim loại tác dụng với phi kim tạo thành muối hoạc oxit. Kim loại tác dụng với axit. - Kim loại đứng trước H trong dãy hoạt động hh tác dụng với H2SO4 loãng và HCl tạo thành muối và giải phóng khí H2. - Kim loại ( - Au, Pt) tác dụng với axit HNO3, H2SO4 đặc tạo muối của kim loại có hóa trị cao nhất + spk + H2O Kim loại tác dụng với nước. Dãy điện hóa kim loại Các phương pháp điều chế kim loại. Ăn mòn kim loại - So sánh bản chất của liên kết kim loại với liên kết ion và liên kết CHT. - Viết cấu hình electron. - Viết phương trình phản ứng. - Làm bài tập kim loại tác dụng với phi kim. - Viết phương trình. - BT kim loại tác dụng với axit. - Bài tập xác định tên kim loại. - Xác định được kim loại tác dụng với nước ở đk thường. - Giải các bài tập liên quan. - Bài tập dãy điện hóa kim loại. - Bài tập về nhiệt luyện, thủy luyện, điện phân. - Bài tập về ăn mòn và chống ăn mòn kim loại 10 28-30 Chủ đề : Kim loại kiềm và hợp chất. - Vị trí, cấu hình e của KLK, - Tính chất hóa học của KLK và hợp chất. - Điều chế. - Viết phương trình. - Tính %m kim loại trong hỗn hợp phản ứng và một số bài tập liên quan. 11 31-33 Chủ đề : Kim loại kiềm thổ và hợp chất. - Vị trí, cấu hình e của KLK thổ . - Tính chất hóa học của KLK thổ và hợp chất. - Điều chế. - Nước cứng, cách làm mềm nước cứng. - Viết phương trình. - Tính %m kim loại trong hỗn hợp phản ứng và một số bài tập liên quan. 12 34-36 Chủ đề : Kim loại nhôm và hợp chất. - Tính lưỡng tính của oxi và hidroxit nhôm. - Phương trình minh họa. - Bài tập nhôm. 13 37-39 Chủ đề sắt và hợp chất sắt. - Tính chất của sắt và một số hợp chất quan trọng của sắt. - Viết phương trình minh họa cho tính chất của sắt. - Nhận biết các ion Fe2+, Fe3+. - Tính % về khối lượng của Fe trong hỗn hợp phản ứng. Xác định tên kim loại dựa vào số liệu thực nghiệm. Tính % về khối lượng các muối Fe hoặc oxit Fe có trong hỗn hợp phản ứng. - Xác định công thức hóa học của oxit Fe. 14 40- 41 Chủ đề : Crom và hợp chất. - Vị trí crom trong BTH. - Tính chất của crom và hợp chất. - Viết phương trình minh họa cho tính chất của crom. - Tính % của Cr, hợp chất của crom trong hỗn hợp phản ứng, xác định tên kim loại và các bài tập khác có nội dung liên quan. - Tính thể tích hoặc nồng độ K2Cr2O7 tham gia phản ứng. 15 42-43 Chủ đề: Đồng và hợp chất. - Vị trí đồng trong BTH. - Tính chất của đồng và hợp chất. - Viết phương trình. - Tính % của Cu hoặc hợp chất đồng có trong hỗn hợp và các bài tập khác có nội dung liên quan. CHƯƠNG I. ESTE- LIPIT A. BÀI TẬP TỰ LUẬN I. ESTE Bài 1. Viết phương trình phản ứng theo công thức tổng quát tạo este từ: a. Axít no, đơn chức và ancol no đơn chức b. Axít đơn chức và ancol đơn chức c. Axít không no, đơn chức (có 1 nối đôi) và ancol no, đơn chức. d. Axít thơm đơn chức và ancol no, đơn chức Bài 2. 1.Viết CTCT và gọi tên các este có CTPT C3H6O2; C4H8O2. 2. Viết công thức cấu tạo của các este sau: isopropyl axetat, metyl metacrylat, n-butyl fomiat, phenyl axetat, metyl benzoat, glixerin triaxetat, etilen glicol đibutirat, đimetyl oxalat, etyl metyl ađipat. Bài 4. Viết ptpư thuỷ phân của các este sau trong môi trường axit, môi trường kiềm: metyl axetat, isopropyl fomiat, isobutyl acrylat, metyl benzoat, vinyl axetat, phenyl axetat, glixerin tristearat, đimetyl axetat. Bài 5: Hoàn thành các phản ứng hóa học sau: a) HCOOC2H5 + NaOH b) HCOOC2H5 + HOH c) HCOOC2H5 + Ba(OH)2 d) HCOOC2H5 + AgNO3/NH3 e) CH2=CH-COO-CH3 + Br2 g) CH2=C(CH3)-COOCH3 h) CH3COO-C6H5 + NaOH dư i) CH3-COO-CH=CH2 + NaOH k) CH2=CH-COO-CH3 + NaOH Bài 6. Phân biệt các chất lỏng sau a/ Glixerol, etanol, andehit fomic . b/ Glixerol, axit fomic, etanol, andehit axetic. c/ phenol, glixerol, benzen, andehit fomic. d/ etyl axetat, glixerol, andehit fomic. e/ etyl fomiat, glixerol, ancol etylic. f/ etyl axetat, glixerol, axit axetic. Bài 7. Đốt cháy hoàn toàn 7,4g este đơn chức (B) thu được 13,2g CO2 và 0,3 mol nước. Tìm CTPT, CTCT và gọi tên B. ĐS: =3 Bài 8. Đốt cháy hoàn toàn 1,48g este (A) tạo bởi axít hữu cơ no, đơn chức và ancol no, đơn chức thu được 1,344 lít CO2 (đkc). Tìm CTPT, CTCT và gọi tên A. ADCT: = 3. Bài 9. Thủy phân hoàn toàn 3g một este đơn chức (B) cần đúng 100ml dd NaOH 0,5M. Tìm CTPT, CTCT và gọi tên B. ĐS: =2. Bài 10. A là este tạo bởi axít no, đơn chức và ancol no, đơn chức. a.Tìm CTPT A biết d A/O2 = 2,3125 ADCT: =3 b.Đun 3,7g A với dung dịch NaOH dư thu được 4,1g muối. Tìm CTCT và gọi tên A. = 15 Bài 11. Xà phòng hoá hoàn toàn 1 este đơn A bằng dung dịch NaOH thu được muối B có KLPT bằng 24/29 KLPT A. Biết d A/CH4 = 7,25. Tìm CTPT, CTCTvà gọi tên A. ĐS: n=6; =29. Bài 12. Phân tích 1,06g một este A thu được 1,32g CO2 và 0,54 g H2O a.Tìm CTĐGN của A b.Tìm CTPT của A biết d A/kk = 2,55. c.Cho A tác dụng với NaOH cho một muối có khối lượng bằng 41/37 khối lượng A. Xác định CTCT và gọi tên A. ĐS: = 15; CH3COOCH3 Bài 13. Một hỗn hợp gồm etyl axetat và etyl fomiat. Muốn thủy phân 5,6g hỗn hợp trên cần 25,96ml dung dịch NaOH 10% (D=1,08g/ml). Xác định thành phần của hỗn hợp. ĐS:x= 0,03 mol, y=0,04 mol. II. BÀI TẬP LIPIT- CHẤT BÉO Bài 1. Viết phương trình phản ứng xảy ra giữa dung dịch NaOH với trioleoyl glixerol( Triolein), tripanmitoyl glixerol(tripanmitin), tristearoyl glyxerol( tristearin). Bài 2. Hãy viết các trieste ( chất béo) được tạo thành từ glixerol, axit panmitic, axit stearic. Bài 3. Tổng số mg KOH cần để trung hòa hết lượng axit tự do có trong 1g chất béo gọi là chỉ số axit của chất béo. Để trung hòa 2,8g chất béo cần 3ml dung dịch KOH 0,1M. Tính chỉ số oxit của mẫu chất béo trên. Bài 4. Tổng số mg KOH cần để thủy phân hết lượng este có trong 1g chất béo gọi là chỉ số este hóa của chất béo. Để thủy phân hết este có trong 4g chất béo A cần 5ml dung dịch KOH 0,1M Tính chỉ số este hóa của mẫu chất béo trên. Bài 5. Tổng số mg KOH cần để trung hòa hết axit tự do và xà phòng hóa hết lượng este có trong 1g chất béo gọi là chỉ số xà phòng hóa hóa của chất béo. Để trung hòa hết axit tự do và xà phòng hóa hết lượng este có trong 4g chất béo cần dùng 10ml dung dịch KOH 0,1M. Tính chỉ số xà phòng hóa của chất béo. Bài 6. a/ Tính chỉ số axit của 1 chất béo biết rằng để trung hòa hết 14g chất béo cần 15ml dung dịch KOH 0,1M. b/ Tính khối lượng KOH cần thiết để trung hòa 10g một chất béo có chỉ số axit bằng 5,6 c/Tính chỉ số xà phòng hóa của chất béo có chỉ số axit bằng 7 chứa tristearoyl có chứa lẫn axit stearic. Hướng dẫn: nKOH = 0,007 : 56 = 0,125 . 10-3 mol. Lượng axit stearic trong 1g chất béo = 0,125 . 10-3 . 284 = 35,5 . 10-3 g. Số mol tri stearoylglixerol trong 1g chất béo là: (1- 35,5 . 10-3) : 890 = 1,0837 . 10-3 mol Suy ra nKOH = 3. 1,0837 . 10-3 mol mKOH = 56. 3. 1,0837 .10-3 . 1000 = 182,06 mg. Chỉ số xà phòng = 182 + 7 = 189 Bài 7. Để xà phòng hóa hết 100kg chất béo ( triolein) có chỉ số axit bằng 7 cần 14,1g KOH. Tính khối lượng muối thu được giả sử các phản ứng xảy ra hoàn toàn. Bài 8. Cho 0,25ml NaOH vào 20g chất béo trung tính và nước rồi đun lên. Sau phản ứng kết thúc cần dung 180ml dung dịch HCl 1M để trung hoà lượng NaOH dư. a.Tính khối lượng NaOH nguyên chất cần xà phòng hoá 1 tấn chất béo trên. b.Tính khối lượng glixerol và xà phòng thu được từ 1 tấn chất béo đó. Bài 9. Đun 85g chất béo trung tính với 250ml dd NaOH 2M cho đến khi phản ứng kết thúc. Để trung hòa lượng NaOH còn dư cần dùng 97ml dung dịch H2SO4 1M. a.Để xà phòng hoá hoàn toàn 1 tấn chất béo trên cần bao nhiêu kg NaOH nguyên chất. b.Từ 1 tấn chất béo đó có thể tạo ra bao nhiêu kg glixerol và bao nhiêu kg xà phòng 72%. Bài 10. Cần bao nhiêu kg chất béo chứa 89% khối lượng trístearin( còn 11% tạp chất trơ bị loại bỏ trong quá trình nấu xà ... hương trình hóa học của các phản ứng xảy ra dưới dạng phân tử và ion thu gọn. Cho biết vai trò của các chất tham gia phản ứng. Khối lượng kim loại thu được sau phản ứng tăng hay giảm bao nhiêu gam so với ban đầu. Bài 24 . Người luyện gang từ quặng chứa Fe3O4 trong lò cao a/ Viết các phương trình xảy ra trong lò cao. b/ Tính khối lượng quặng chứa 92,8% Fe3O4 để có 10 tấn gang chứa 4% và một số tạp chất . Giả thiết hiệu suất của quá trình là 87,5%. Bài 25 . a/ Viết các phương trình phản ứng của quá trình luyện thép từ gang. b/ Cần bao nhiêu tấn muối chứa 80% sắt (III) sunfat để có một lượng Fe bằng lượng Fe có trong 1 tấn quặng hematit chứa 64% Fe2O3. c/ Nếu lấy quặng hematit trên đem luyện gang, rồi luyện thép thì từ 10 tấn quặng sẽ thu được bao nhiêu tấn thép chứa 0,1%C và các tạp chất. Giả thiết hiệu suất cỉa quá trình là 75%. Bài 26 . Cho 3,08g Fe vào 150 ml dung dịch AgNO3 1M, lắc kĩ cho phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Tính m. Bài 27. Ngâm một lá kim loại M có khối lượng 50g trong dung dịch HCl. Sau khi thu được 336 ml H2 đkc thì khối lượng lá kim loại giảm 1,68%. Xác định kim loại M Bài 28 . Cho Fe tác dụng với dung dịch H2SO4 loãng thu được V lít H2 đkc, dung dịch thu được cho bay hơi được tinh thể FeSO4.7H2O có khối lượng là 55,6g. Tính thể tích H2 giải phóng ra ở đkc. Bài 29. Một loại quặng sắt trong thiên nhiên đã được loại bỏ tạp chất. Hòa tan quặng này trong dung dịch HNO3 thấy có khí màu nâu bay ra, dung dịch thu được cho tác dụng với dung dịch BaCl2 thấy có kết tủa trắng ( không tan trong axit mạnh). Xác định quặng sắt ở trên. Bài 30 . Để khử hoàn toàn 17,6g hỗn hợp gồm Fe, FeO,Fe3O4, Fe2O3. đến Fe cần vừa đủ 2,24 lít CO đkc. Tính khối lượng sắt thu được. Bài 31. Nung một mẫu thép thường có khối lượng 10g trong oxi dư thu được 0,1568 lít khí CO2 đkc. Xác định % của cacbon có trong mẫu thép đó. Bài 32 . Cần bao nhiêu tấn quặng manhetit chứa 80% Fe3O4 để sản xuất được 800 tấn gang có hàm lượng Fe là 95%. Biết rằng trong quá trình sản xuất lượng Fe hao hụt là 1%. Bài 33 . Ngâm một đinh sắt nặng 4g trong dung dịch CuSO4, sau một thời gian lấy đinh sắt ra, sấy khô, cân nặng 4,2857g. Tính khối lượng Fe tham gia phản ứng. Bài 34 . Hỗn hợp A có FeO, Fe3O4, Fe2O3. Trong hỗn hợp A, mỗi oxit đều có 0,5 mol a/ Tính khối lượng của hỗn hợp A. b/ tính khối lượng của oxi có trong hỗn hợp A B. BÀI TẬP TRẮC NGHIỆM KHÁCH QUAN Câu 1: Ngâm 1 đinh sắt sạch trong 200 ml dung dịch CuSO4. Sau khi phản ứng kết thúc, lấy đinh sắt ra khỏi dung dịch, rửa nhẹ, sấy khô, thấy khối lượng đinh sắt tăng thêm 0,8 gam. Nồng độ mol/l của dung dịch CuSO4 ban đầu là A. 1,5M B. 0,5M C. 0,6M D. 0,7M Câu 2: Khi cho Fe vào dung dịch hỗn hợp các muối AgNO3, Cu(NO3)2, Pb(NO3)2 thì Fe sẽ khử các ion kim loại theo thứ tự ( ion đặt trước sẽ bị khử trước). A. Ag+, Pb2+,Cu2+ B. Cu2+,Ag+, Pb2+ C. Pb2+,Ag+, Cu2 D. Ag+, Cu2+, Pb2+ Câu 3: Cho các cặp oxi hoá khử sau: Fe2+/Fe; Cu2+/Cu; Fe3+/Fe2+. Từ trái sang phải tính oxi hoá tăng dần theo thứ tự Fe2+, Cu2+, Fe3+ và tính khử giảm dần theo thứ tự Fe, Cu, Fe2+. Điều khẳng định nào sau đây là đúng: A. Fe không tan được trong dung dịch CuCl2. B. Cu có khả năng tan được trong dung dịch CuCl2. C. Fe có khả năng tan được trong các dung dịch FeCl3 và CuCl2. D. Cu có khả năng tan được trong dung dịch FeCl2. Câu 4: Fe có Z =26. Cấu hình electron của ion Fe2+ là: A. 1s22s22p63s23p63d44s2. B. 1s22s22p63s23p63d6. C. 1s22s22p63s23p63d54s1. D. Kết quả khác. Câu 5: Đốt cháy 8,4 gam Fe trong bình chứa lưu huỳnh (phản ứng vừa đủ). Khối lượng muối thu được là A. 12,0 gam B. 14,5 gam C. Kết quả khác. D. 13,2 gam Câu 6: Hoà tan 2,4 gam một oxit sắt cần vừa đủ 90 ml dung dịch HCl 1M. Công thức của oxit sắt nói trên là A. Fe2O3. B. FeO C. Fe3O4. D. Công thức khác. Câu 7: Cho 0,64 gam Cu tác dụng với axit HNO3 đặc, dư. Thể tích khí NO2 (đktc) thu được sau phản ứng là A. 22,4 ml B. 224 ml C. 448 ml D. 44,8 ml Câu 8: Từ Fe2O3 người ta điều chế Fe bằng cách A. điện phân nóng chảy Fe2O3. B. khử Fe2O3 ở nhiệt độ cao. C. nhiệt phân Fe2O3. D. Tất cả đều đúng. Câu 9: Cặp kim loại nào sau đây thụ động trong axit HNO3 đặc, nguội? A. Mg, Fe B. Al, Ca. C. Al, Fe. D. Zn, Al Câu 10: Chia m gam hỗn hợp Fe, Cu làm 2 phần bằng nhau: Phần 1: Cho tác dụng với axit HCl dư thì thu được 2,24 lit khí H2 (đktc). Phần 1: Cho tác dụng với axit HNO3 loãng thì thu được 4,48 lit khí NO (đktc). Thành phần % khối lượng kim loại Fe trong hỗn hợp là A. 26,6%. B. 63,2%. C. 36,8%. D. Kết quả khác. Câu 11: Câu 14: Hoà tan hoàn toàn 12g hỗn hợp Fe, Cu ( tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít ( đktc) hỗn hợp khí X ( gồm NO và NO2 ) và dung dịch Y ( chỉ chứa hai muối và axit dư ). Tỉ khối của X đối với H2 bằng 19. Gía trị của V là A. 3,36 B. 4,48 C. 2,24 D. 5,60 Câu 12: Khi nung nóng Fe với chất nào sau đây thì tạo ra hợp chất sắt (II) A. S B. Dung dịch HNO3 C. O2 D. Cl2 Câu 13: Cu tác dụng với dung dịch bạc nitrat theo phương trình ion rút gọn Cu + 2Ag+ = Cu2+ + 2 Ag. Trong các kết luận sau, kết luận sai là A. Cu2+ có tính oxi hoá yếu hơn Ag+. B. Cu có tính khử mạnh hơn Ag. C. Ag+ có tính oxi hoá mạnh hơn Cu2+. D. Ag có tính khử yếu hơn Cu. Câu 14: Liên kết trong hợp kim là liên kết A. kim loại và cộng hoá trị. B. ion. C. cộng hoá trị. D. kim loại. Câu 15: Các tính chất vật lý chung của kim loại gây ra do A. Trong kim loại có các electron tự do. B. Có nhiều kiểu mạng tjinh thể kim loại. C. Các kim loại đều là chất rắn. D. Trong kim loại có các electron hoá trị. Câu 16: Câu 15: Cho hỗn hợp Fe, FeO, Fe2O3 tác dụng vừa đủ với 200 ml dung dịch HNO3 3M thu được 5,376 lít ( đktc) khí NO duy nhất. Số mol muối sau phản ứng là : A. 0,12 mol B. 0,36mol C. 0,24mol D. 0,4 mol Câu 17: Khi clo hoá 30g bột đồng và sắt cần 1,4 lit khí clo(đktc).Thành phần % của đồng trong hhợp đầu là A. 46,6% B. 55,6% C. 44,5% D. 53,3% Câu 18: Người ta có thể dùng thùng bằng sắt để đựng A. ddHCl B. dd H2SO4 loãng. C. dd HNO3 đặc, nguội. D. dd HNO3 loãng. Câu 19: Khi cho các chất: Ag, Cu, CuO, Al, Fe vào dung dịch axit HCl thì các chất đều bị tan hết là A. Cu, Al, Fe B. Cu, Ag, Fe C. CuO, Al, Fe D. Al, Fe, Ag Câu 20: Cho Na kim loại lượng dư vào dung dịch CuCl2 sẽ thu được kết tủa là A. Cu(OH)2 B. CuCl C. Cu D. Tất cả đều đúng. Câu 21: Phát biểu nào sau đây là đúng? A. Hợp kim là hỗn hợp gồm nhiều kim loại khác nhau. B. Nhiệt độ nóng chảy của hợp kim thường thấp hơn nhiệt độ nóng chảy của các kim loại tạo nên hợp kim C. Tinh thể xêmentit Fe3C thuộc loại tinh thể dung dịch rắn. D. Hợp kim thường mềm hơn các kim loại tạo nên hợp kim. Câu 22: Câu 16: Đốt 10,08g phôi bào sắt trong không khí thu được 24gam hỗn hợp B chứa Fe, FeO, Fe3O4 , Fe2O3 . Hòa tan hoàn toàn B trong dung dịch HNO3 loãng dư thu được V lít khí NO duy nhất ( đktc). Gía trị của V là A. 4,48 B. 3,36 C. 1,12 D. 2,24 Câu 23: Dung dịch FeSO4 có lẫn tạp chất CuSO4. Chất nào sau đây có thể loại bỏ được tạp chất? A. Bột Mg dư, lọc. B. Bột Cu dư, lọc. C. Bột Al dư, lọc. D. Bột Fe dư, lọc. Câu 24: Cho các cặp oxi hoá – khử sau: Ca2+/ Ca (1); Cu2+/ Cu (2); Fe2+/ Fe (3); Au3+/ Au (4); Na+/ Na (5); Ni2+/ Ni (6). Sắp xếp theo thứ tự tăng tính oxi hoá của các ion kim loại là A. (6) < (5) < (4) < (3) < (2) < (1). B. (1) < (2) < (3) < (4) < (5) < (6). C. Kết quả khác. D. (5) < (1) < (3) < (6) < (2) < (4). Câu 25: Cho Fe (Z=26). Cấu hình electron của nguyên tử Fe là A. 1s22s22p63s23p63d8. B. 1s22s22p63s23p64s23d6. C. 1s22s22p53s3. D. 1s22s22p63s23p63d64s2. Câu 26: Đốt cháy 9,6 gam Mg trong không khí. Biết oxi chiếm 20% không khí thì thể tích không khí (đktc) cần dùng là: A. 11,2 lit B. 33,6 lit C. 22,4 lit D. 44,8 lit Câu 27: Hoà tan hoàn toàn m gam Fe trong 100 ml dung dịch AgNO3 2M. Giá trị của m là A. 11,2 gam B. 16,8 gam C. 5,6 gam D. Kết quả khác. Câu 28: Đốt cháy 16,8 gam Fe trong không khí. Biết oxi chiếm 20% thể tích không khí thì thể tích không khí (đktc) cần dùng là A. 4,48 lit B. 11,2 lit C. 22,4 lit D. Kết quả khác. Câu 29: Hoà tam m gam Cu vào dung dịch HNO3 đặc, nóng, dư. Dau phản ứng thu được 3,36 lit khí NO (đktc) duy nhất. Giá trị của m là A. 6,4 gam B. 14,4 gam C. 9,6 gam. D. 4,8 gam Câu 30: Phản ứng Fe + HNO3 à Fe(NO3)3 + NH4NO3 + H2O. Tổng các hệ số cân bằng của phản ứng là A. 9 B. 20 C. 64 D. 58 Câu 31: Sắt kim loại bị oxi hoá trong dung dịch bởi ion kim loại nào dưới đây? A. Fe3+. B. Al3+. C. Zn2+. D. Mg2+. Câu 32: Chất nào sau đây có thể khử Fe2+ thành Fe? A. Ag+. B. H+. C. Cu D. Na Câu 33: Thể tích oxi (đktc) cần để tác dụng hết 4,8 gam kim loại Mg là A. 3,36 lit. B. 4,48 lit. C. 2,24 lit. D. 1,12 lit. Câu 34: Hỗn hợp chứa 5,6 gam Fe và 4,8 gam Mg. Cho hỗn hợp tác dụng với axit HCl dư thì thể tích khí (đktc) thu được là A. 11,2 lit. B. 6,72 lit C. 4,48 lit D. 8,96 lit Câu 35: Hoà tan hoàn toàn 24,8 gam hỗn hợp Mg, Cu trong dung dịch axit HCl dư, sau phản ứng thu được 4,48 lit khí H2 (đktc). Thành phần % kim loại Cu trong hỗn hợp đầu là A. 80,9%. B. 80,4%. C. 19,6%. D. Kết quả khác. Câu 36: Chia m gam hỗn hợp Fe, Cu làm 2 phần bằng nhau Phần 1: Cho tác dụng với axit HCl dư thì thu được 2,24 lit khí H2 (đktc). Phần 2: Cho tác dụng với axit HNO3 loãng thì thu được 4,48 lit khí NO (đktc). Giá trị của m là A. 60,8 gam B. 15,2 gam C. 30,4 gam D. Kết quả khác. Câu 37: Cho 5,6 gam Fe tác dụng với 400 ml dung dịch HNO3 1M ta thu được dung dịch X và khí NO. Khối lượng muối có trong dung dịch X là A. 21,6 gam B. 26,44 gam C. 24,2 gam D. 4,84 gam. Câu 38: Cho 0,01 mol Fe vào 50 ml dung dịch AgNO31M. Khi phản ứng xảy ra hoàn toàn thì khối lượng Ag thu được là A. 2,16g B. 5,4g C. 3,24g D. giá trị khác. Câu 39: Hoà tan 12,8 gam Cu trong axit H2SO4 đặc, nóng, dư thì thể tích khí SO2 (đktc) thu được là A. 4,48 lit. B. 2,24 lit. C. 6,72 lit. D. Kết quả khác. Câu 40: Cho 5,02 g hỗn hợp A ở dạng bột gồm Fe và một kim loại M có hoá trị không đổi bằng 2 ( đứng trước H trong dãy điện hoá). Chia A thành 2 phần bằng nhau. Cho phần 1 tác dụng với dung dịch HCl dư thấy có 0,4 mol khí H2. Cho phần 2 tác dụng hết với dung dịch HNO3 loãng đun nóng thấy thoát ra 0,3 mol khí NO duy nhất. Kim loại M là A. Mg B. Ni C. Sn D. Zn Câu 41: Cho 0,1mol Fe vào 500 ml dung dịch AgNO3 1M thì dung dịch thu được chứa A. AgNO3 B. AgNO3 và Fe(NO3)2 C. Fe(NO3)3 D. AgNO3 và Fe(NO3)3 Câu 42: Hoà tan 15 gam Al, Cu trong axit HCl dư, sau phản ứng thu được 3,36 lit khí hiđrô (đktc). Khối lượng muối thu được sau phản ứng là A. 12,25 gam B. 26,7 gam C. 13,35 gam D. Kết quả khác. Câu 43: Hoà tan 19,2 gam Cu trong axit H2SO4 đặc, nóng thì thể tích khí SO2 (đktc) thu được là A. 4,48 lit. B. 2,24 lit. C. 6,72 lit. D. 5,60 lit. Câu 44: Hoà tan 7,2 gam Mg trong axit H2SO4 đặc, nóng thì thể tích khí H2S (đktc) thu được là A. 2,24 lit. B. 5,60 lit. C. 4,48 lit. D. 6,72 lit. Câu 45: Vai trò của Fe trong phản ứng Cu + 2Fe(NO3)3 = Cu(NO3)2 + 2Fe(NO3)2 là A. chất bị oxi hoá. B. chất khử. C. chất bị khử. D. chất trao đổi. Câu 46: Cho 1 luồng H2 qua ống sứ đựng 0,8 gam CuO được chất rắn có khối lượng 0,672 gam. Phần trăm CuO bị khử là A. 75% B. 60% C. Kết quả khác. D. 80%
Tài liệu đính kèm:
 on thi tot nghiep theo chuong.doc
on thi tot nghiep theo chuong.doc





